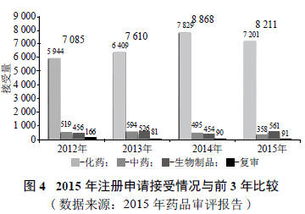
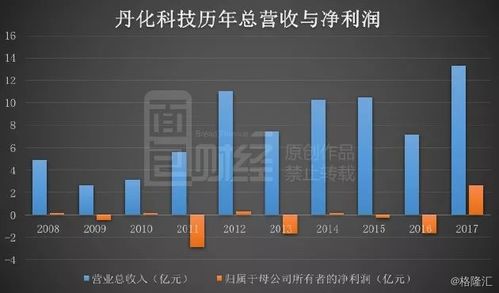
新版藥品技術轉讓規(guī)定核心解讀 深化審評審批制度改革,激發(fā)創(chuàng)新活力

為適應我國醫(yī)藥產業(yè)高質量發(fā)展需求,深化藥品審評審批制度改革,國家藥品監(jiān)督管理局近期對藥品技術轉讓相關規(guī)定進行了重要修訂與完善。新版規(guī)定旨在進一步規(guī)范技術轉讓行為,保障藥品質量,同時激發(fā)市場創(chuàng)新活力,優(yōu)化資源配置。以下是對其主要內容和影響的幾點解讀。
一、 明確適用范圍與分類管理
新版規(guī)定進一步厘清了藥品技術轉讓的范疇,主要包括新藥技術轉讓、仿制藥技術轉讓以及藥品生產地址變更伴隨的技術轉讓等情形。根據(jù)轉讓品種的創(chuàng)新程度、風險等級及對公眾健康的影響,實施分類、分級管理。對于創(chuàng)新藥或具有明顯臨床優(yōu)勢的藥品技術轉讓,審評審批程序可能設立優(yōu)先通道,以鼓勵真正有價值的創(chuàng)新成果轉化。
二、 強化全過程質量與責任體系
規(guī)定著重強調了轉讓方與受讓方在藥品全生命周期中的質量主體責任。要求技術轉讓必須基于完整的研發(fā)、生產及質量控制數(shù)據(jù)的轉移,確保受讓方具備完全重現(xiàn)原產品質量的能力。轉讓前后的產品必須進行嚴格的藥學對比研究,乃至必要的生物等效性或臨床試驗,以充分證明技術轉移未引起產品質量、安全性和有效性的任何負面變化。責任鏈條更加清晰,實現(xiàn)了從“文號轉移”到“技術能力實質轉移”的深化。
三、 優(yōu)化審評審批流程與時限
為提高效率,新規(guī)整合并優(yōu)化了技術轉讓的申報資料要求和審評流程。鼓勵采用模塊化申報,避免重復提交資料。明確了不同情形下技術審評和現(xiàn)場核查的重點與銜接機制,并嘗試設定更清晰的審評時限預期。這些措施有助于降低制度性交易成本,加快成熟技術在產業(yè)內的合理流動。
四、 鼓勵創(chuàng)新與資源整合
新規(guī)的導向之一是促進醫(yī)藥創(chuàng)新和產業(yè)結構優(yōu)化。一方面,為鼓勵早期研發(fā)創(chuàng)新,對于尚在臨床試驗階段的新藥,其技術轉讓的條件和路徑可能更為靈活。另一方面,通過規(guī)范化的技術轉讓機制,有利于淘汰落后產能,促使優(yōu)勢生產資源向具備競爭力的企業(yè)集中,提升行業(yè)整體水平。
五、 加強信息公開與監(jiān)管協(xié)同
規(guī)定要求加強藥品技術轉讓相關信息的公開透明度,接受社會監(jiān)督。強化國家與省級藥品監(jiān)管部門的協(xié)同,在技術審評、生產現(xiàn)場核查、上市后監(jiān)管等環(huán)節(jié)形成合力,確保技術轉讓后產品的持續(xù)合規(guī)與安全。
而言,新版藥品技術轉讓規(guī)定并非簡單的程序調整,而是我國藥品監(jiān)管科學化、法治化、國際化進程中的重要一環(huán)。它通過更科學的分類、更嚴格的質量要求、更高效的流程以及更明確的政策導向,致力于構建一個更健康、更具創(chuàng)新活力的藥品研發(fā)與生產生態(tài)體系,最終惠及公眾健康。相關藥品上市許可持有人、生產企業(yè)及研發(fā)機構需深入理解新規(guī)要求,提前規(guī)劃,確保技術轉讓活動合規(guī)、高效、成功。
如若轉載,請注明出處:http://www.neina.cn/product/72.html
更新時間:2026-02-08 06:09:20